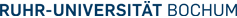Projekte
Biospektroskopie
Hochdurchsatz-FTIR-Spektroskopie an Körperflüssigkeiten
Das Infrarotabsorptionsspektrum einer Körperflüssigkeit - Blut, Urin, Liquor etc. - stellt eine biochemische Momentaufnahme der enthaltenen Substanzen dar. Die multivariate quantitative Auswertung ergibt analog zu klassischer klinischer Chemie Konzentrationen von Schlüsselsubstanzen, die zu einer Krankheitsdiagnose nützlich sein können.
Im Rahmen von PURE werden Biomarker-relevante spektrale Merkmale insbesondere für onkologische und neurodegenerative Erkrankungen erforscht. Dazu ist die quantitative Identifikation einzelner Substanzen nicht notwendig. Stattdessen werden anhand der biochemischen Fingerabdrücke spektrale Muster zur Unterscheidung von Proben gesunder und erkrankter Probanden identifiziert. Identifikation und Validierung erfolgt mit dedizierter bioinformatischer Auswertung.
Anders als bei der Analyse von Gewebeproben kann je Patient und Körperflüssigkeitsprobe nur ein repräsentatives Spektrum akquiriert werden. Um eine hohe Anzahl von Proben verlässlich und reproduzierbar zu erfassen, wurde ein Hochdurchsatz-FTIR-Spektrometersystem entwickelt. Durch eine weitgehende Automatisierung aller Abläufe erfolgen die wesentlichen Schritte von Präparation und Auswertung ohne Einflussnahme des Benutzers. Durch die neuartige Probenpräparation wurde die dafür notwendige hervorragende spektrale Reproduzierbarkeit erreicht (Ollesch et al., 2013).

Ein Tropfen hochkonzentrierter Protein- und Salzlösung wie Blut trocknet unter Bildung eines sogenannten Kaffee-Rings. Es bildet sich eine Krater-förmige Struktur mit hoher Konzentration ehemals gelöster Stoffe am Rand des Tropfens, während eine gleichmäßigere Dicke in der Mitte erreicht wird. Wird die Probe in vielen kleinen Portionen appliziert, minimiert sich der Effekt. Viele kleine Tropfen verschmelzen zu einer FTIR-spektroskopisch homogenen Oberfläche.

Mit automatisierten Vorverarbeitungs-Programmen werden messtechnische Artefakte aus den Infrarot-Absorptionsspektren entfernt. Dadurch werden vom Nutzer unbeabsichtigte, subjektive Manipulationen, die das spätere Klassifikationsergebnis verfälschen könnten, vermieden.
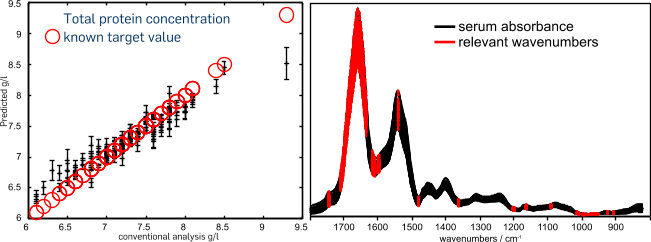
Eine wesentliche Prozedur der Auswertung ist die Auswahl klassifikationsrelevanter Merkmale. Diese sogenannte “Feature selection” identifiziert Wellenzahl-Intensitäts-Paare zur optimalen Differenzierung der analysierten Klassen. Auf spektralen Daten hat sich ein Verfahren bewährt, das auf dem Random Forest Klassifikator beruht und ein Relevanz-Ranking der Daten ergibt.
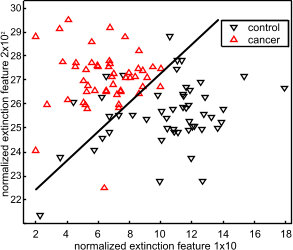
Mit diesem Verfahren wurden spektrale Merkmale identifiziert, anhand derer histopathologisch bestätigte Blasenkrebspatienten von Harnwegsinfektionspatienten mit Genauigkeit, Sensitivität und Spezifität von jeweils über 90 % unterschieden wurden (Ollesch et al., 2014).
Literatur
Ollesch, J., Drees, S.L., Heise, H.M., Behrens, T., Brüning, T., und Gerwert, K. 2013: "FTIR Spectroscopy of Biofluids Revisited: An Automated Approach to Spectral Biomarker Identification."
The Analyst 138 (14): 4092-102. doi:10.1039/c3an00337
Ollesch, J., Heinze, M., Heise, H.M., Behrens, T., Brüning, T., und Gerwert, K. 2014: "It's in your blood: spectral biomarker candidates for urinary bladder cancer from automated FTIR spectroscopy."
J Biophotonics. 2014 Jan 7. doi: 10.1002/jbio.201300163. [Epub ahead of print]
Durch eine hohe Akzeptanz in der Bevölkerung für eine möglichst nicht-invasive Gewinnung von Körperflüssigkeiten (hier Urin) der direkten tumorösen Umgebung zur Vor- und Nachsorge ergibt sich durch die Spektrale Zytopathologie (SZP), bei der die in den Körperflüssigkeiten enthaltenen Zellen analysiert werden, sowohl ein prädiktiver als auch diagnostischer Zugang, um möglichst frühzeitig sich entwickelnde Tumoren zu erkennen. Herkömmliche zytologische Verfahren beschränken sich hauptsächlich auf Zelluntersuchungen mit dem Lichtmikroskop nach vorheriger Färbung und sind arbeits- und zeitaufwendig bei einer gleichzeitig ungünstigen Reproduzierbarkeit. Wir etablierten mit der SZP auf vibrationsspektroskopischer Basis eine schnelle, einfache und reproduzierbare markerfreie Methode zur Zelluntersuchung an der Entität Harnblasenkarzinom. Ziel hierbei ist es, zwischen verschiedenen Zelltypen und zwischen „gesund“ und „krank“ zu unterscheiden.
Mit Hilfe der IR-Spektroskopie und nachgeschalteter bioinformatorischer Methoden können so die verschiedenen Zelltypen und jeweils die „gesunden“ von „kranken“ Zellen mit einer Auflösung von ~2,7 µm anhand ihres biochemischen Zustands differenziert werden. Um subzelluläre Komponenten verschiedenster Zelltypen räumlich spektral aufzulösen, näher zu charakterisieren und Zelltypen aufgrund ihrer Morphologie unterschieden zu können, werden sie durch die Raman-Spektroskopie, die eine höhere Auflösung (~300 nm) hat, analysiert.
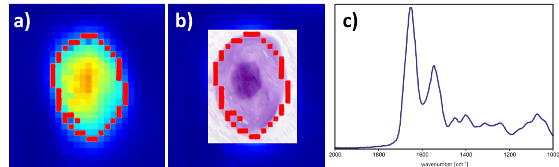
Automatisierte Zellerkennung: a) spektrale Identifizierung einer Zelle anhand der Intensität der Proteinkonzentration (je röter, desto mehr Protein) und Abgrenzung vom Hintergrund (rote Linie); b) automatische Überlagerung der im spektralen Bild erkannten Zelle (rote Linie) und der gefärbten Zelle; c) gemitteltes und korrigiertes Spektrum der Zelle zur bioinformatorischen Weiterverarbeitung.
High-Throughput FTIR-Spektroskopie
- Bruker Vertex 70v Vakuum-Spektrometer
- HTS-XT 384 well Mikrotiterplatten-Leseeinheit
- „Twister“ Mikrotiterplattenwechselroboter
- Bruker Vertex 70v mit micro-biolytics manueller Durchflusszelle AquaSpec™ Injektionseinheit (MIU) inkl. PAL HTS-xt Autosampler LHS 800 mit LHS-StackCooler2DW von CTC Analytics
- Dispensierautomat M2 Automation iTWO

Konventionelle FTIR-Spektroskopie
- 4 Bruker Vertex 80v Vakuumspektrometer, Stepscan- und ATR-Betrieb
- Bruker Vertex 70
- Bruker Alpha, mit Diamant-ATR-Zelle
- Bruker IFS 66v/s
- Bruker IFS 66v
- Bruker IFS 66
- Bruker IFS 88 mit Smiths Detection DuraSamplIR Diamant-ATR-Zelle

Laser
- Lambda Physik LPX 200
- Lambda Physik LPX 300
- Lambda Physik LPX pro
- Spectra Physics Quanta Ray
Dr. Julian Ollesch (Hochdurchsatz-FTIR-Spektroskopie)
Dr. Sven Brucker (Spektrale Zytopathologie)