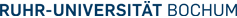Projekte
Biospektroskopie
Bildgebende Spektroskopie
FTIR-Imaging
Wie die Papillarleisten des Fingerabdruckes steht jedes ortsaufgelöste Spektrum für den momentanen biochemischen Status eines Gewebes oder eines Krankheitsstadiums zum Zeitpunkt der Entnahme der Probe. Diese Tatsache machen wir uns beim FTIR-Imaging zu Nutzen und erzeugen eine Datenbank für unterschiedliche Gewebetypen und Krankheitsstadien. Dazu nutzen wir spezielle FPA-Detektoren (focal plane array), die 4096 bzw. 16384 Spektren simultan aufnehmen können, wodurch eine schnelle und kontinuierliche Datengewinnung erfolgen kann.
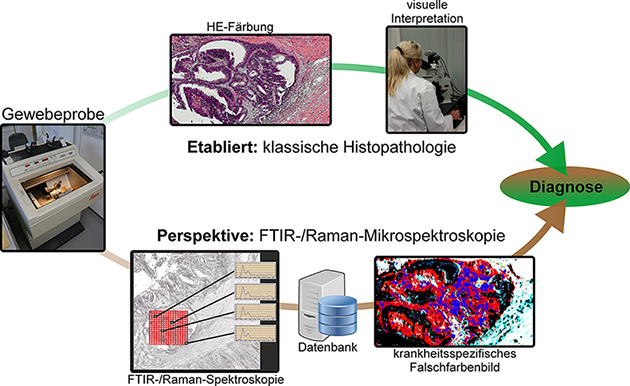
Abb. 1: schematischer Ablauf der klassischen und spektralen Histopathologie
Zu diesem Zeitpunkt haben wir an Datenbanken zur Erkennung von Gewebekomponenten der Blase, des Darms und der Lunge gearbeitet. Hier kann bereits zwischen Tumor, dessen Art und Grading, Entzündungen und gesundem Gewebe unterschieden werden. Im weiteren Verlauf soll die Erkennung spezieller Tumorarten, des Entdifferenzierungsgrades sowie die Klassifikation weiter verfeinert und in die klinische Anwendung gebracht werden. Die spektral gewonnenen Daten werden mit Fluoreszenz- und klassischer H&E-Färbung kuriert.
Ausstattung
 Bruker Hyperion 3000 Mikroskop Focal Plane Array (FPA) Detektor 64x64 Elemente (Pixelgröße 2.7x2.7µm²) Bruker Vertex 70 Spektrometer |  Agilent Cary 620 Mikroskop Focal Plane Array (FPA) Detektor 128x128 Elemente (Pixelgröße 5.5x5.5µm²) Agilent Cary 670 Spektrometer |
Raman Spektroskopie
Die Raman Spektroskopie ist eine nicht-invasive Vibrationsspektroskopie, die sowohl für Punkt-, Endoskopie- und abbildende Messungen eingesetzt werden kann. Die Methode ist markerfrei, d.h. es werden keinerlei Farbstoffe (wie in Fluoreszenzmessungen) oder andere Markierungen (z. B. Antikörper) benötigt, da direkt die Schwingungen der eigentlichen Probe, und damit ihrer molekularen Zusammensetzung und Struktur, abgetastet werden.
Diese vibrationsspektroskopischen Informationen können also ohne aufwendige Probenvorbereitung gewonnen und beispielsweise für den medizinischen Einsatz, Diagnosezwecke oder pathologische Untersuchungen genutzt werden. Weiterhin ist von Vorteil, dass für Raman unterschiedlichste Anregungswellenlängen eingesetzt werden können, vom Ultravioletten bis ins Infrarot, so dass für jede Anwendung die Passende ausgewählt werden kann (abhängig von beispielweise Fluoreszenzuntergrund oder Absorptionen).
Im Einsatz als eine abbildende Technik (Raman Mikroskopie bzw. Raman Mikrospektroskopie) kommen weitere Vorteile zum Tragen: Die hohe räumliche Auflösung, welche in einer konfokalen Messanordnung noch weiter gesteigert ist, erlaubt es sogar subzelluläre Strukturen aufzulösen und zu identifizieren. Die konfokale Messung ermöglicht nicht nur eine flächenmäßige, sondern sogar räumliche Auflösung, was bedeutet, dass nicht nur die Oberfläche einer Probe untersucht werden kann, sondern auch das Volumen, z. B. das Innere einer Zelle, welche dann dreidimensional mit ihrem Inhalt zur Betrachtung steht.
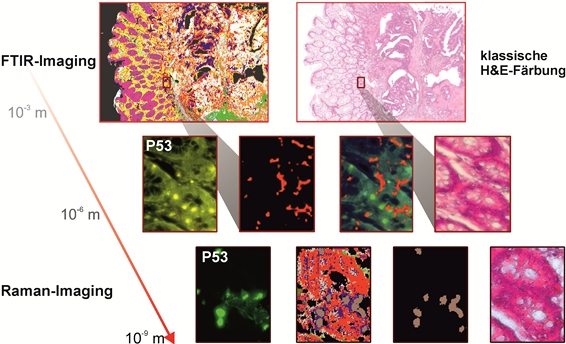
Abb. 2: Gezeigt sind FTIR- und Raman-Imaging Analysen von Gewebeschnitten eines kolorektalen Karzinoms. Hierbei wird von Oben nach Unten eine stärkere Vergrößerung gezeigt. Mit der automatisierten Erkennung des Gewebes durch FTIR-Imaging ist hier eine Auflösung bis 10 µm möglich. Auf der rechten Seite ist der klassisch gefärbte H&E-Schnitt zu sehen, während auf der linken Seite die Ergebnisse der Erkennung durch FTIR-Imaging zu sehen sind. Durch eingehendere Betrachtung konnte hier gezeigt werden, dass bereits veränderte Krypten detektiert werden können, was durch eine immunhistochemische Fluoreszenzfärbung (P53) bestätigt wurde. Um eine höhere Auflösung der aktivierten Zellkerne zu erreichen, wurde Raman-Imaging mit einer Auflösung bis 300 nm eingesetzt (untere Zeile). Die P53 aktiven Zellkerne in den veränderten Krypten können hier im Vergleich zu einer Fluoreszenzfärbung (P53, grün) sehr gut korreliert werden, dies liegt auch an einer beobachteten starken Autofluoreszenz. Im Gegensatz zur Fluoreszenz können die FTIR- und Raman-Technik allerdings viel mehr Informationen liefern.
Ebenso kann die Raman Mikrospektroskopie für Messungen an komplexen Geweben eingesetzt werden, beispielsweise Darmkrebsproben. Dieses örtlich und spektral hochaufgelöste Bild kann dann unter Zuhilfenahme von pathologischen Zuordnungen und einer parallelen Fluoreszenzmessung genutzt werden, um bioinformatische Klassifizierer zu trainieren, die im folgenden Schritt automatisch gesundes von krankhaftem Gewebe unterscheiden und sogar einzelne Gewebekomponenten und Zellen erkennen können.
Die Raman Mikrospektroskopie ist also eine flexible, nicht-invasive und markerfreie Technik, die sehr gut mit weiteren Untersuchungsmethoden wie zum Beispiel konfokaler oder Fluoreszenzmikroskopie kombiniert werden kann. Zu den möglichen Techniken gehören dabei unter anderem spontane Raman Spektroskopie, Resonanz Raman Spektroskopie, oberflächenverstärktes Raman (SERS, Surface Enhanced Raman Spectroscopy), kohärente Anti-Stokes Raman Spektroskopie (CARS) und Stimulierte Raman Spektroskopie (SRS). Wobei die beiden Letztgenannten sogar bildgebende Ramanstreuung mit hohen Wiederholraten („Videoraten“) ermöglichen.
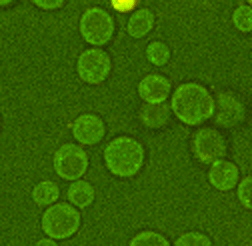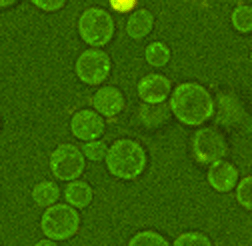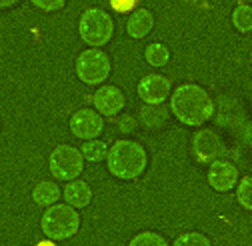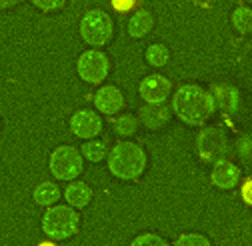
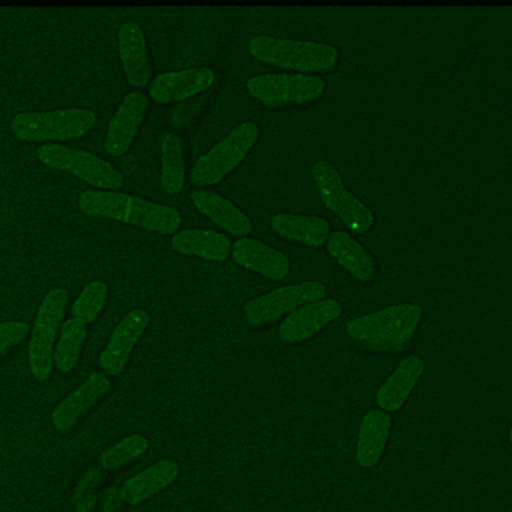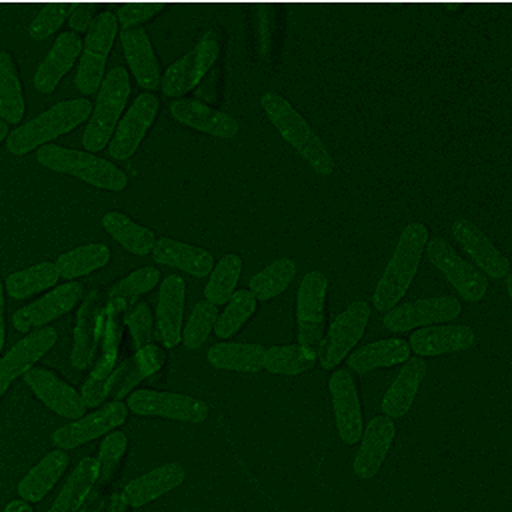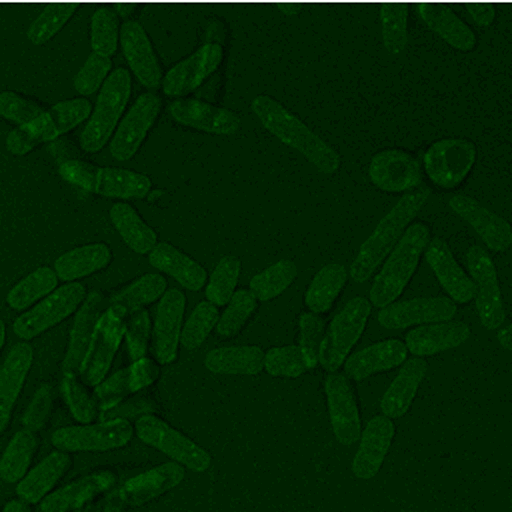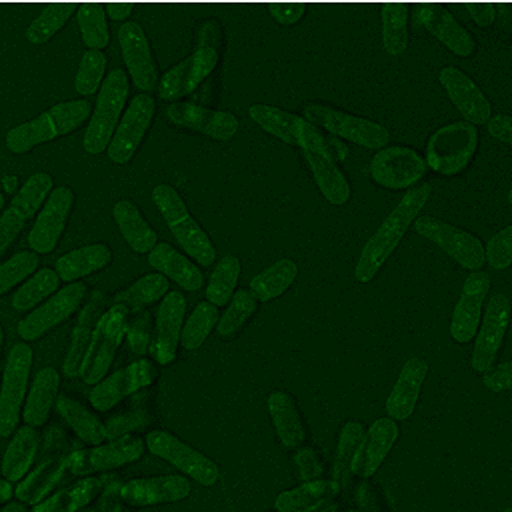
Abb. 3: Zeitaufgelöste Aufnahmen von Zellen sind beispielsweise mit der CARS Mikroskopie ohne Schädigung der Probe auch über lange Zeiträume möglich, hier beispielhaft dargestellt an zwei Hefestämmen, es kann jeweils eine vollständige Zellteilung verfolgt werden. Links Saccharomyces cerevisiae, die sich über Sprossung vermehrt und rechts Schizosaccharomyces pombe, die sich über Spaltung vermehrt. Diese Messungen fanden teils über mehrere Tage am Lehrstuhl für Biophysik statt, die Proben blieben also trotz andauernder Messungen lebens- und teilungsfähig.
Bei der Entwicklung neuer Medikamente sind die Mechanismen der Aufnahmen und Verteilung des Wirkstoffs in der Zelle oder dem Gewebe für die Bewertung der pharmazeutischen Eigenschaften des Medikaments von entscheidender Bedeutung. Kürzlich konnten wir mittels markerfreiem Raman-Imaging die Verteilung des Wirkstoffs Erlotinib in Kolonkrebszellen zeigen (El-Mashtoly et al., 2013). Die Ergebnisse deuten darauf hin, dass der Wirkstoff im Organismus zu einem demethylisierten Derivat metabolisiert wird. Unsere Ergebnisse belegen eindrucksvoll das große Potential der Raman-Mikroskopie als nicht-invasive und markerfreie Methode zur Untersuchung der Pharmakokinetik von Wirkstoffen.
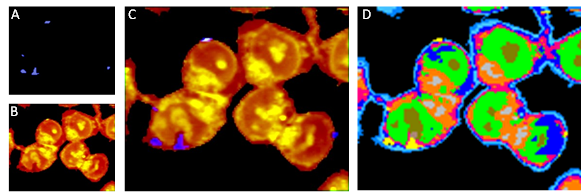
Abb. 4: Integrierte Raman-Intensitäten der (A) C≡C Streckschwingung, Marker für Erlotinib und (B) der C―H Streckschwingung, die Lipide und Proteine der Zelle anzeigen. (C) Überlagerung von (A) und (B). (D) Falschfarbenbild, basierend auf Raman-Daten von Kolonkrebszellen (grün: Nukleus, grau: Lipidtröpfchen (lipid droplets), gelb: Erlotinib).
Ausstattung
 WiTec Alpha 300AR Konfokales Ramanmikroskop Rasterkraftmikroskop 532nm Laser (Nd:YAG) 633nm Laser (HeNe) |  Leica TCS SP5 II Konfokales CARS- und Fluoreszenzmikroskop 457-514nm Laser (Ar) 561nm Laser (DPSS) 633nm Laser (HeNe) APE PicoEmerald Laser System: 1064nm (Nd:YVO) 780-960nm (OPO) 390-470nm, 532nm (Zweiphotonenfluoreszenz) |